2024年10月Science期刊精华
来源:生物谷原创 2024-10-29 11:01
我国科学家揭示水熊虫耐受高剂量辐射机制、新研究揭示拟杆菌如何通过转移遗传因子击败对手、在怀孕期间和大量出血后,逆转录转座子激活造血干细胞,从而促进血细胞产生
2024年10月份即将结束,10月份Science期刊又有哪些亮点研究值得学习呢?小编对此进行了整理,与各位分享。
1. Science:我国科学家揭示水熊虫耐受高剂量辐射机制
doi:10.1126/science.adl0799
在一项新的研究中,来自中国多家研究机构的研究人员重点研究了一种新发现的水熊虫(tardigrades)物种,对水熊虫能够抵御高剂量辐射的方法有了更多的了解。相关研究结果发表在2024年10月25日的Science期刊上,论文标题为“Multi-omics landscape and molecular basis of radiation tolerance in a tardigrade”。
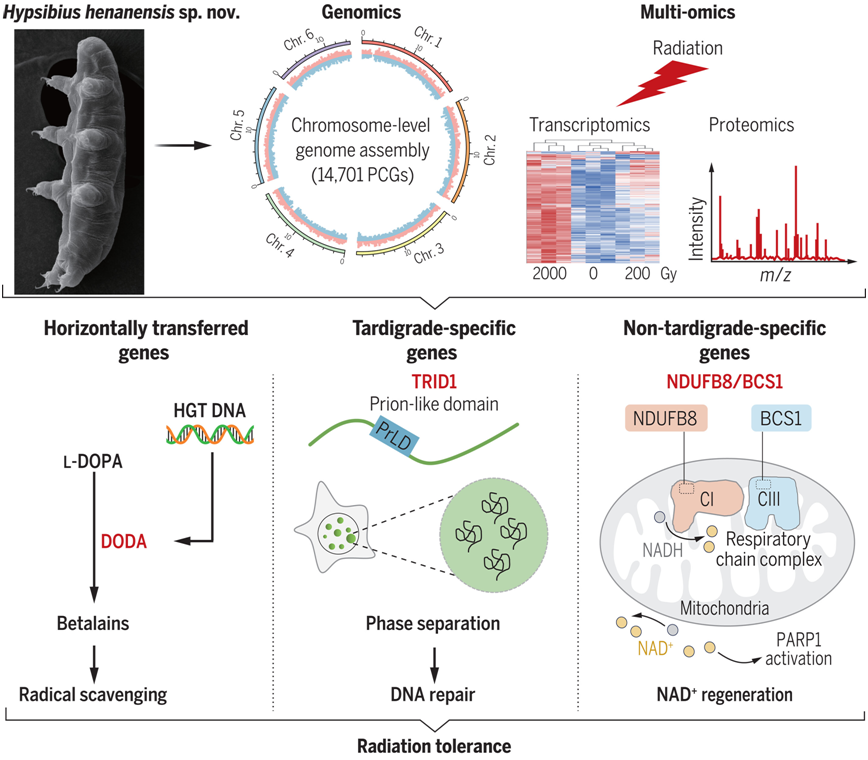
河南高生熊虫耐受辐射的机制示意图
这项研究始于六年前,当时他们在中国河南省发现了一种新的水熊虫物种。他们将其命名为 “河南高生熊虫(Hypsibius henanensis)”,并对其基因组进行了测序。他们发现它有 14701 个基因,其中约 30% 是水熊虫特有的。随后,他们将注意力转向了用γ射线轰击这种生物的DNA——从低剂量到高剂量,所产生的影响。
作者发现,水熊虫 DNA 中的 2801 个基因参与了 DNA 修复。更具体地说,他们发现有三个关键因素帮助它在辐射暴露中存活下来。
首先是它修复受损 DNA 的能力。DNA 会受到γ射线等辐射的破坏,因为辐射会将电子从组成原子中击出,使其电离。电离会导致DNA螺旋断裂,有时还会引发癌性肿瘤。作者发现,河南高生熊虫能够利用一种只有水熊虫才能制造的名为 TRID1 的蛋白快速修复这种DNA损伤。
第二个因素涉及一个基因,该基因在暴露于辐射时开启,从而产生了两种蛋白BCS1和NDUFB8,众所周知,这两种蛋白对线粒体合成 ATP 非常重要,而在水熊虫中,它们似乎也有助于 DNA 修复。第三个因素是河南高生熊虫能够产生大量的蛋白,这些蛋白是有效的抗氧化剂---它们能在自由基对这种生物的细胞造成问题之前将其清除,从而将辐射损伤降到最低。
2. 肠道细菌也能开外挂?Science:新研究揭示拟杆菌如何通过转移遗传因子击败对手
doi:10.1126/science.adj9504
在我们的肠道里,细菌们就像是一群小战士,通过互相分享基因来快速进化。拟杆菌(Bacteroidales)是一类大量存在的肠道细菌,它们可以交换数百种基因。但这些基因转移对细菌或宿主健康的具体影响,我们还知之甚少。
最近,芝加哥大学的研究人员发现了一种大型、无处不在的移动遗传因子(Mobile Genetic Element, MGE),它改变了常见的人类肠道细菌——脆弱拟杆菌(Bacteroides fragilis)的对抗性武器。相关研究结果发表在2024年10月25日的Science期刊上,论文标题为“A ubiquitous mobile genetic element changes the antagonistic weaponry of a human gut symbiont”。
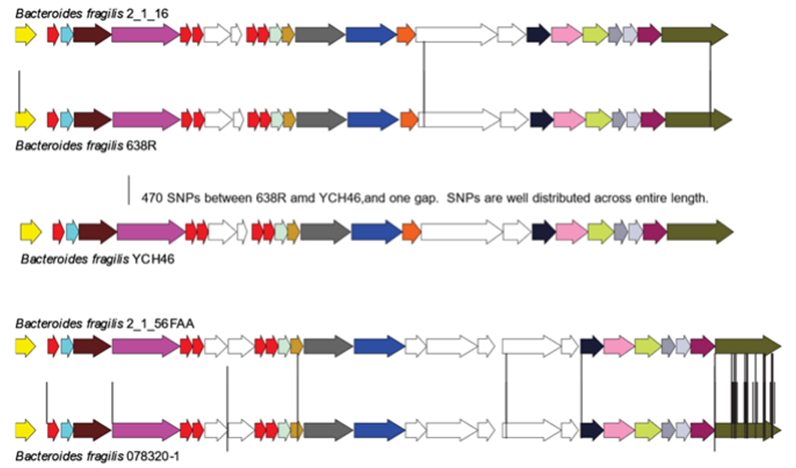
具有相同V1和V2区的脆弱拟杆菌菌株GA3位点的核苷酸差异示意图
许多拟杆菌属物种都能通过产生毒素来杀死邻近的细菌。有些毒素会从细菌细胞扩散到周围环境中,消灭附近的敏感菌株。另一种武器是VI型分泌系统(Type VI Secretion System, T6SS),它就像是一个装有弹簧的带毒长矛,直接将毒素注入邻近的细胞。
拟杆菌的T6SS有三种不同的类型,分别是GA1、GA2和GA3。其中,GA3是脆弱拟杆菌特有的,能有效杀死其他拟杆菌属物种。而GA1和GA2则是由一种称为整合性接合元件(Integrative and Conjugative Element, ICE)的大型移动遗传因子编码的。这些ICE在全世界人类肠道中的拟杆菌属物种之间迅速传播。
芝加哥大学微生物学教授Laurie Comstock博士研究了拟杆菌的不同拮抗机制和它们转移DNA的方式已有十多年。她发现,当脆弱拟杆菌获得了一种较大的移动遗传因子后,它的GA3武器就会失效,但同时又获得了一种新的武器——GA1 T6SS。这种变化帮助细菌在肠道内开辟出新的“壁龛”,保护提供移动遗传因子DNA的供体菌株。
3. Science:在怀孕期间和大量出血后,逆转录转座子激活造血干细胞,从而促进血细胞产生
doi:10.1126/science.ado6836
在一项新的研究中,来自德克萨斯大学西南医学中心的研究人员报告说,人类基因组中的古老病毒残余在怀孕期间和大量出血后被激活,以增加血细胞的生成,这是确定人类基因组中“垃圾DNA”用途的重要一步。相关研究结果于2024年10月24日在线发表在Science期刊上,论文标题为“Retrotransposons are co-opted to activate hematopoietic stem cells and erythropoiesis”。
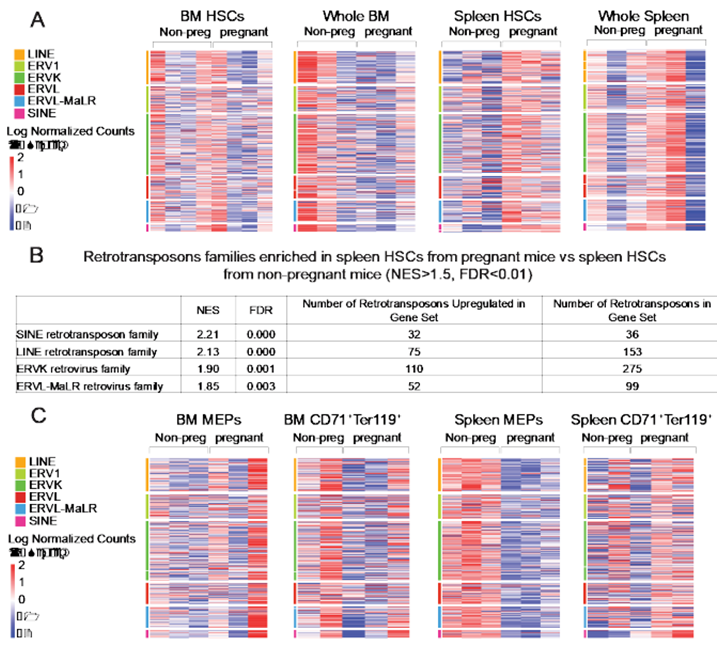
逆转录转座子在妊娠期间优先在脾脏造血干细胞中表达
德克萨斯大学西南医学中心儿童医学中心研究所主任Sean J. Morrison博士和论文第一作者Julia Phan博士着手探索通常很少分裂的造血干细胞在怀孕期间和失血后如何被激活。当他们比较怀孕小鼠和未怀孕小鼠体内造血干细胞中的激活基因时,发现怀孕小鼠体内的造血干细胞中的逆转录转座子已经开启。
随着进一步探索激活血细胞生成的机制,他们发现逆转录转座子被免疫传感蛋白cGAS和STING检测到。在病毒感染或逆转录转座子复制后,这些传感蛋白会诱导干扰素的产生。
Phan博士说,“我们原以为干扰素会导致造血干细胞被免疫系统杀死。但我们发现,逆转录转座子开启的干扰素刚好足以激活血细胞的生成。”
4. 肠道“小厨师”大显身手!Science:揭示一种肠道微生物酶具有惊人的代谢能力,助力营养不良儿童健康成长
doi:10.1126/science.ado6828
如果有一种神奇的食物能够滋养肠道中的有益微生物,帮助营养不良的儿童更好地成长,那该有多好?这不,来自圣路易斯华盛顿大学医学院的研究人员就开发出了一种治疗性食物,这种食物可以改善儿童的生长和其他健康指标。为了弄清楚这种食物是如何起作用的,由医生科学家Jeffrey I. Gordon领导的一个研究小组深入研究了儿童肠道微生物组对这种疗法的反应。相关研究结果发表在2024年10月25日的Science期刊上,论文标题为“A human gut Faecalibacterium prausnitzii fatty acid amide hydrolase”。
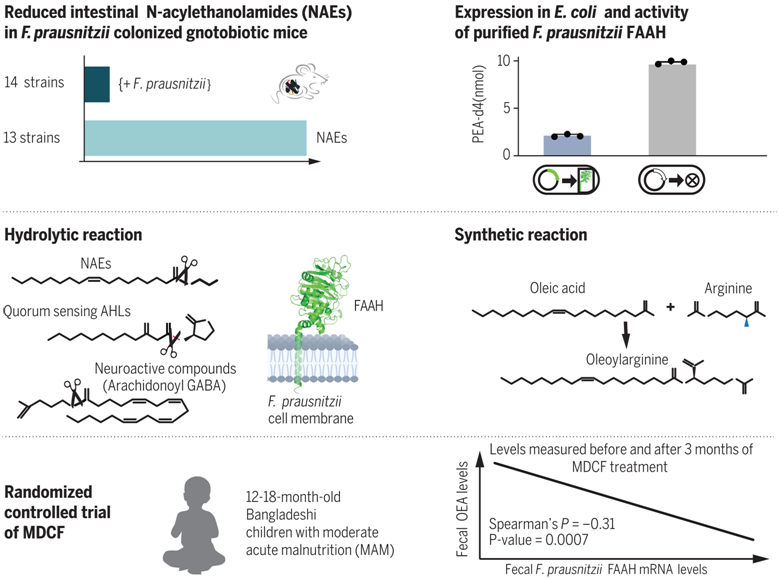
调控肠道内N-乙酰乙醇胺的普氏栖粪杆菌酶FAAH的发现和表征
在这项新的研究中,Gordon团队发现了一种特殊的肠道细菌,它与孟加拉国儿童在接受一种旨在滋养健康肠道微生物的治疗性食物后更好地成长有关。这种以微生物为导向的治疗性食物被称为MDCF-2。研究人员发现,儿童肠道微生物群落中携带的这种细菌菌株拥有一种以前未知的基因,能够产生和代谢许多关键分子,这些分子参与调节食欲、免疫反应、神经元功能以及病原菌的致病能力。
Gordon说:“当我们通过修复儿童肠道微生物组来治疗营养不良时,我们有机会深入了解我们的微生物伙伴的内部运作。我们正在揭示肠道微生物如何影响我们身体的不同方面。这项研究表明,肠道微生物是生化大师,它们拥有我们一直没有意识到的代谢能力。”
5. Science:利用一种将BCL6和CDK9粘附在一起的分子胶水,可让癌细胞自我摧毁
doi:10.1126/science.adl5361
通过一种名为细胞凋亡的自然细胞清除和更替过程,我们的身体每天要清除 600 亿个细胞。这些细胞,主要是血细胞和肠道细胞,都会被新的细胞取代,但我们身体清除自身物质的方式可能会对癌症疗法产生深远影响。
在一项新的研究中,来自斯坦福大学医学院的研究人员利用这种自然的细胞死亡方法来诱使癌细胞自我处理。他们通过人为地将两种蛋白结合在一起,开启一组细胞死亡基因,最终促使肿瘤细胞自我关闭。相关研究结果发表在2024年10月4日的Science期刊上,论文标题为“Relocalizing transcriptional kinases to activate apoptosis”。
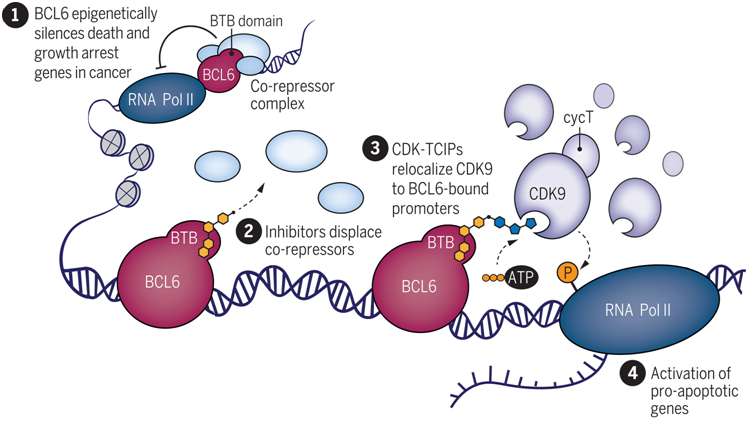
将激酶抑制剂转化为治疗基因的激活剂
作为其中的一种蛋白,BCL6一旦发生突变,就会诱发弥漫性大细胞 B 细胞淋巴瘤。在淋巴瘤中,发生突变的 BCL6 位于细胞凋亡促进基因附近的 DNA 上,使这些基因处于关闭状态,从而帮助癌细胞保持其特有的不死特性。作者开发了一种分子,将BCL6与一种名为CDK9的蛋白绑定在一起,其中CDK9是一种催化基因活化的酶,可以激活BCL6通常关闭的一组凋亡基因。
作者在实验室对弥漫性大细胞B细胞淋巴瘤细胞进行测试时发现,这种分子确实能高效杀死癌细胞。他们还在健康小鼠体内测试了这种分子,没有发现明显的毒副作用,尽管这种分子杀死了它们体内特定类别的健康B细胞,即一种也依赖于BCL6的免疫细胞。如今,他们正在患有弥漫性大B细胞淋巴瘤的小鼠体内测试这种化合物,以衡量它在活体动物体内杀死癌症的能力。
鉴于这种技术依赖于这些细胞天然供应的BCL6和CDK9蛋白,它似乎对淋巴瘤细胞非常特异——BCL6蛋白只存在于这种淋巴瘤细胞和一种特定的B细胞中。作者在实验室中用 859 种不同的癌细胞测试了这种分子,发现这种嵌合化合物只能杀死弥漫性大细胞 B 细胞淋巴瘤细胞。
6. Science:新的研究表明在化学物混合物中,单个化学物的神经毒性效应会累加
doi:10.1126/science.adq0336
如今,化学物无处不在。它们通过食物、空气或皮肤进入我们的身体。但是,这些复杂的化学混合物是如何影响我们的健康的呢?在一项新的研究中,来自亥姆霍兹环境研究中心的研究人员指出在人体中发现的以复杂混合物和浓度比出现的化学物共同起作用。相关研究结果发表在2024年10月18日的Science期刊上,论文标题为“Neurotoxic mixture effects of chemicals extracted from blood of pregnant women”。
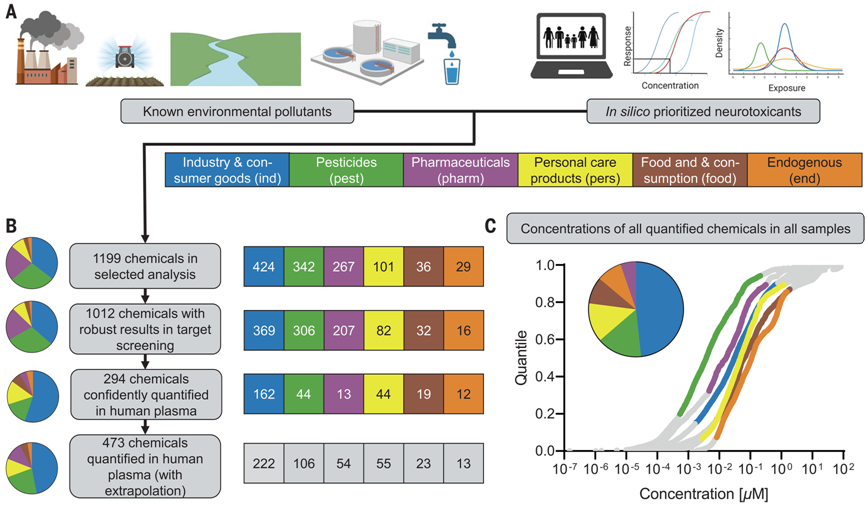
图片来自Science, 2024, doi:10.1126/science.adq0336
即使单个化学物的浓度均低于效应阈值,混合物中的化学物也会产生累积性神经毒性效应。在研究过程中,他们使用了自 2006 年起在亥姆霍兹环境研究中心开展的 LiNA 母子研究(生活方式和环境因素及其对新生儿过敏风险的影响)中孕妇的血液样本。
论文通讯作者、亥姆霍兹环境研究中心细胞毒理学系主任Beate Escher 教授说,“在我们的日常生活中,我们会接触到各种各样的化学物,这些化学物会在我们体内分布和积累。这些高度复杂的混合物会影响身体机能和我们的健康。环境和水研究已表明当化学物以低浓度出现在复杂的混合物中时,它们的影响会叠加。至于人体中是否也存在这种情况,我们还没有进行充分的研究,这正是我们研究的目的所在。”
7. Science:新研究鉴定出人类肠道内分泌细胞的营养传感蛋白
doi:10.1126/science.adl1460
在一项新的研究中,由胡布勒支研究所和罗氏人类生物学研究所领导的一个多机构研究团队开发出了确定肠道激素分泌调节因子的新工具。这些激素是由肠道中稀有的激素分泌细胞对进入肠道的食物做出反应而分泌的,并在管理消化和食欲方面发挥关键作用。
利用他们的工具,他们可识别这些激素分泌细胞表面上潜在的 “营养传感蛋白”,并研究它们的功能。这可能会产生干扰这些激素释放的新策略,并为治疗多种代谢或肠道运动障碍提供途径。相关研究结果发表在2024年10月18日的Science期刊上,论文标题为“Description and functional validation of human enteroendocrine cell sensors”。
图片来自Science, 2024, doi:10.1126/science.adl1460
Hubrecht 团队之前已经开发出在人体类器官中提取大量EEC的方法。类器官包含与其来源器官相同的细胞类型,因此有助于探索EEC等细胞的发育和功能。他们利用一种特殊的蛋白——Neurogenin-3,生成了大量的EEC。
在这项新的研究中,这个多机构研究团队成功地在包括胃部在内的消化系统其他部位的类器官中富集了EEC。与真实的胃部一样,这些胃部类器官也会对已知的激素释放诱导剂做出反应,并分泌大量的胃饥饿素(Ghrelin),其中该激素向大脑发出饥饿信号方面起着关键作用。这证实了这些类器官可用于研究EEC的激素分泌。
8. Science:含有隐形斗篷序列的DNA分子可选择性地靶向运动神经元疾病中的病变细胞
doi:10.1126/science.adk2539
在一项新的研究中,来自弗朗西斯-克里克研究所和伦敦大学学院(UCL)的研究人员开发出含有“隐形斗篷(invisibility cloak)”序列的DNA分子,可用于阻止健康细胞读取它们含有的信息。相关研究结果发表在2024年10月4日的Science期刊上,论文标题为“Creation of de novo cryptic splicing for ALS and FTD precision medicine”。
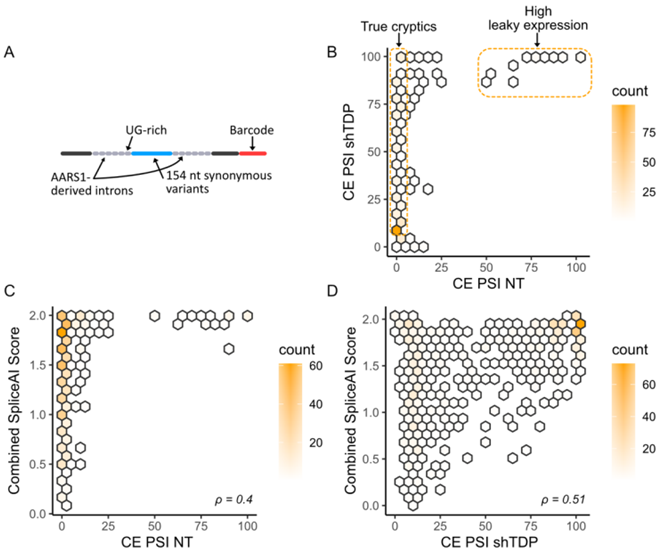
图片来自Science, 2024, doi:10.1126/science.adk2539
只有在受肌萎缩性脊髓侧索硬化症(ALS),又称运动神经元疾病(MND),影响的细胞中,隐形斗篷序列才会被移除,从而使得他们开发的DNA分子能够对这些细胞进行重新编程,并有望改善它们的健康状况。他们希望,这将为包括 ALS 和额颞叶痴呆症(FTD)在内的更多神经退行性疾病带来更安全的治疗方法。
领导这项研究的Oscar Wilkins说,“虽然神经退行性疾病具有破坏性影响,但我们可以估计,患者体内真正患病的细胞不到0.00001%。我们面临的挑战是找到一种方法,特异性地靶向治疗这些极少部分的患病细胞,同时避免对99.99999%的健康细胞进行不必要的治疗。”研究团队围绕一种名为TDP-43的蛋白的活性开发了一种新方法。
在健康细胞中,这种蛋白位于DNA附近,帮助细胞正确解读DNA的遗传指令。然而,在患病细胞中,TDP-43 蛋白会滞留在细胞的远处,使其远离 DNA,从而破坏对遗传信息的解读。
通过精心设计和使用人工智能预测工具,他们构建出了行为相反的 DNA 序列。在健康细胞中,来自 DNA 的信息会被破坏,而在患病细胞中,这些信息可以被正确解读。他们希望,通过隐藏对抗疾病的指令,基因疗法将变得更安全、更有效,因为它们只会在占一小部分的患病细胞中被激活。
9. Science:破坏特殊基因或能预防T细胞耗竭从而改善免疫疗法的疗效
doi:10.1126/science.adl4492
免疫疗法能利用患者自身的免疫系统来治疗疾病,其在一些癌症患者身上展现出了一定的希望,但对于大多数患者而言却并不奏效。近日,一篇发表在国际杂志Science上题为“Epigenetic regulators of clonal hematopoiesis control CD8 T cell stemness during immunotherapy”的研究报告中,来自圣犹达儿童研究医院等机构的科学家们通过研究发现,破坏T细胞中名为Asxl1的基因或能改善称之为免疫检查点阻滞的免疫疗法的敏感性,并能改善模型系统中的长期肿瘤控制。
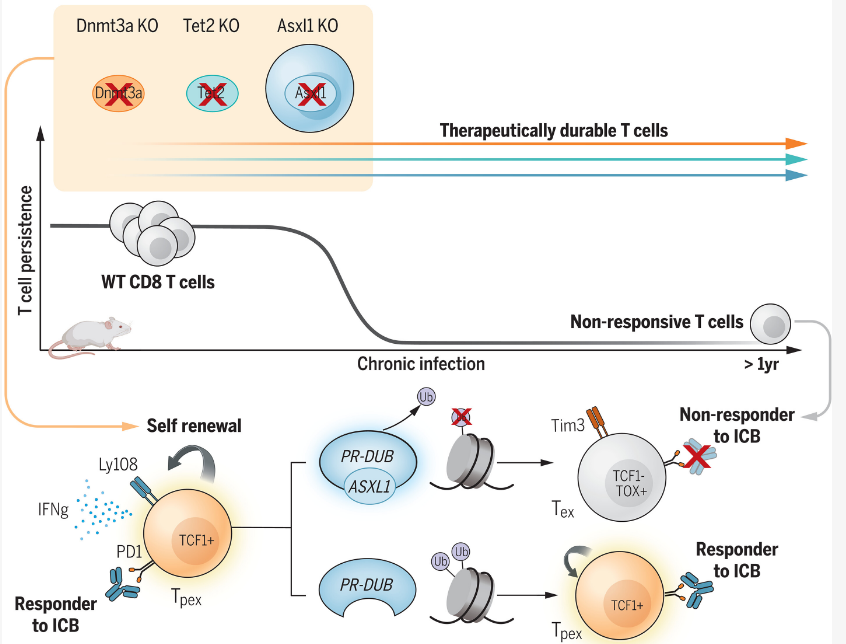
破坏特殊基因或能预防T细胞耗竭从而改善免疫疗法的疗效
免疫系统中的细胞能利用“检查点”(checkpoints)或信号来告诉他们如何对疾病细胞或病原体产生反应,肿瘤能拦截这些检查点从而关闭免疫系统的功能,并帮助癌细胞隐藏和生存。免疫检查点抑制剂或阻滞能阻断肿瘤的抑制性作用,并帮助免疫系统发现同时杀死癌细胞。医学博士Caitlin Zebley说道,我们发现,破坏T细胞中的Asxl1基因就会导致机体对免疫检查点阻滞疗法产生更好的反应。遭遇太多肿瘤细胞碎片的T细胞也会发生耗竭且会失去杀死癌细胞的能力,通过移除Asxl1就能防止T细胞耗竭,从而就能实现长期的免疫反应。
研究人员发现,Asxl1能控制表面遗传学检查点,而表观遗传学检查点则能加强T细胞最终分化并进入耗竭状态,当T细胞分化过了这个检查点后,其就会在免疫疗法中基本是无用的,研究者发现,这种分子检查点事该领域的一个关键进步,因为如今其能允许科学家们进一步设计具有持久抗肿瘤反应的T细胞。为了获得这一发现,就需要免疫细胞信号和免疫疗法相关领域的专业知识,以及来自已经成功通过免疫检查点阻滞疗法治疗的患者的样本,这就凸显出了科学研究中合作的重要性。
10. Science:新研究表明mRNA疫苗可保护小鼠的肠道免受艰难梭菌感染
doi:10.1126/science.adn4955
在一项新的研究中,来自美国几家研究机构的研究人员介绍了他们如何利用 mRNA 技术设计出一种多管齐下的疫苗,即一种靶向艰难梭菌(Clostridioides difficile)导致肠道疾病所需的几种蛋白的mRNA疫苗,以及该疫苗在小鼠模型测试中的表现。他们发现这种mRNA疫苗能够保护这些小鼠免受艰难梭菌引起的肠道感染。相关研究结果发表在2024年10月4日的Science期刊上,论文标题为“A multivalent mRNA-LNP vaccine protects against Clostridioides difficile infection”。
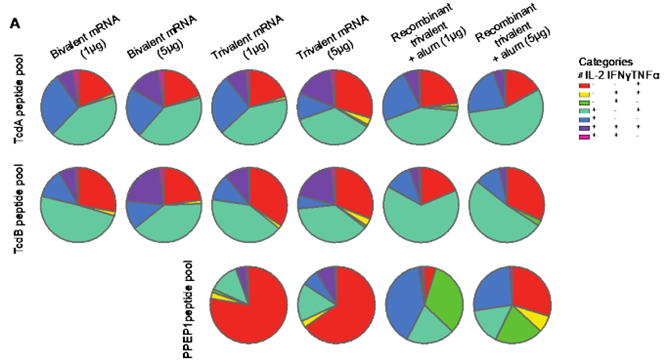
图片来自Science, 2024, doi:10.1126/science.adn4955
用于抗击 COVID-19 的mRNA疫苗中的mRNA需要让人类 T 细胞产生蛋白,所产生的蛋白会间接干扰SARS-CoV-2附着到它们试图感染的人类细胞上的能力。研究者利用 mRNA 让免疫系统的多种成分(免疫球蛋白、T 细胞和抗体)产生多种类型的蛋白,从而在艰难梭菌生命周期的不同阶段对抗这种细菌,确保在宿主体内有效消灭它们。
在测试他们开发的mRNA疫苗的过程中,研究者发现这种疫苗非常有效,所有被注射了正常致死剂量艰难梭菌的小鼠模型都康复了,而对照组的小鼠全部死亡。他们指出,与其他基于 mRNA 的疫苗一样,他们的疫苗并不能预防感染,而是为免疫系统提供了有效对抗感染的手段。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


